Zelluläre Automaten - Bakterien
Wachstum und Ausbreitung von Bakterien
Wir wollen diese Wachstumsform an zwei Beispielen kennen lernen, der sozialen Amöbe Dyctyostelium discoideum und ausgewählten Bakterienarten.
Bei Dyctyostelium discoideum handelt es sich um einen Schleimpilz, bestehend aus Einzellern (Bild N° 1).
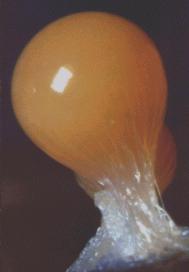
Bild N° 1: Dyctyostelium discoideum
Die Amöben leben vorerst gut versorgt in der Humusschicht des Waldes.
Sie vegetieren als Einzelleben umher. Diese Phase heißt daher auch
vegetatives Stadium. Die soziale Amöbe durchlebt in ihrem Zyklus von
Leben und Sterben allerdings auch eine zweite Phase. Diese Phase wird als
vielzelliges Stadium bezeichnet, da sich die Amöben zum Schleimpilz
zusammenschließen. Die Zellen differenzieren sich dann zu den sogenannten
Prespore (Fruchtkörper) und Prestalk (Stiel) Zellen.
Doch was führt die Amöben dazu ihr lohnendes Einzelleben
im Namen der Gesellschaft aufzugeben? Meistens führt ein akuter Nahrungsmangel einer Amöbe dazu, dass
sie das Hormon cAMP (zyklisches Adenosinmonophosphat) ausstößt.
Dieses bewirkt ein sofortiges Zusammenziehen der Zellen. Es ist bekannt,
dass dieses cAMP in Wellenfronten auftaucht, ähnlich der Belousov–Zhabotinsky–Reaktion.
Durch diese konzentrischen cAMP Wellen können sich die Amöben
hin zu einem gemeinsamen Mittelpunkt orientieren.
Das Wellenmuster ist damit zu erklären, dass die Amöbe auf
ihrer Zellmembran zwei verschiedene Arten von Rezeptoren für cAMP
besitzt.
Die Amöben beginnen, falls sie über ihren Rezeptor 1 das
cAMP wahrnehmen, mit seiner Produktion. So wird die Welle laufend verstärkt
und trägt so über große Strecken Information zum Zusammenzug.
Ohne Unterbruch dieser Wellen ist es für eine Zelle äußerst
schwer zum Mittelpunkt zu gelangen. Daher weist die Oberfläche der
Amöbe auch noch den anderen Rezeptor (2) auf. Ab einer gewissen cAMP
Konzentration hemmt dieser die Produktion (Bild N° 2).
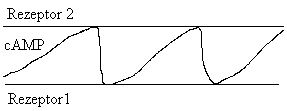
Bild N° 2: Schema der Wellenentstehung durch cAMP
Das Wechselspiel dieser beiden Aufnahmeorgane bringt periodische Wellenmuster
zum Vorschein. Durch diese Schübe kann die Amöbe schneller die
anderen ausmachen.
Die Amöben schließen sich dann zum sogenannten Slug. In
diesem wurmähnlichen Gebilde finden sich die Prespore- und Prestalkzellen
zusammen. Der Slug bewegt sich nun einem besseren, nahrungsreicheren Ort
an der Oberfläche zu. Die Prestalkzellen wandern entgegengesetzt kreiselnd
in der Spitze nach oben, die Presporezellen bewegen sich in Richtung des
Slugs. Dieses Bewegungsmuster ähnelt einer dreidimensionalen Wellenfront
der Belousov-Zhabotinsky-Rekation. Die Amöbe
bildet im Slug ihre Scheinfüßchen aus, um durch chemische Analyse
ihren Weg zu ersuchen. Ist erst ein guter Platz gefunden, stellen sich
die Prestalkzellen auf und bilden mit den Presporezellen, welche die Sporen
übernehmen, den Schleimpilz. Durch Insekten oder den Wind werden diese
Zellen nun weggetragen um an einem anderen Ort eine neue Amöbenkultur
zu gründen.
Man nennt diese Kleinstlebewesen soziale Amöben, da die Prestalkzellen
nachher alle absterben. Das heißt, ein Teil der Population opfert
sich, um den anderen die Möglichkeit der Pilzformung zu geben.
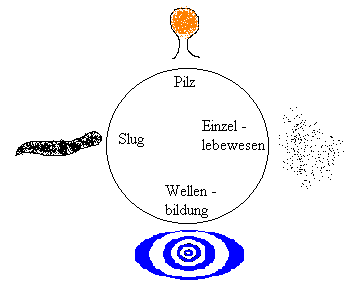
Bild N° 3: Der Lebenskreislauf der sozialen Amöbe
Nach der Betrachtung der sozialen Amöbe wenden wir uns den Bakterien zu.
Wenn wir an Bakterien denken, fällt uns auf, dass sie kaum als
Einzellebewesen vorkommen. Sie siedeln sich in Kolonien an. Um eine Kolonie
zu gründen, braucht es zweierlei: eine Kommunikation und die Möglichkeit
sich fortzubewegen.
Die Bakterienkolonien sind meist undefinierbare Haufen von Leben. Was
kann diese Haufen dazu bewegen, eine Struktur oder ein Muster zu entwickeln?
Die Forscher Eshel Ben-Jacob, Ofer Shochet und Adam Tenenbaum untersuchten
diese Musterbildung am Bakterium Bacillus subtilis. Normalerweise,
wenn wir Bakterien züchten, siedeln wir diese auf einer möglichst
nährreichen Agarlösung an. Die oben genannten Forscher setzten
den Nährstoffgehalt der Nährplatte herab und siehe da, die vorher
undefinierbare Masse der Kolonie begann ein Muster auszubilden.

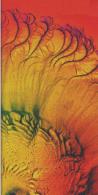
Bild N° 4 und 5: Bakterienkolonien mit Muster
Welches ist aber der Grund, dass Nährstoffknappheit zur Musterbildung
führt? Die Bakterien haben durch diese Verzweigungen einen größeren
Wirkungsradius. Es braucht weniger Zellen um den Raum zwischen den Nährstoffteilchen
zu überbrücken, als wenn all die Zwischenräume aufgefüllt
werden müssten.
Die gesamte Kolonie erkennt die Nährstoffknappheit durch Kommunikation
der einzelnen Zellen. Diese kann durch direkte Zell-Zell-Kontakte stattfinden
oder mit Hilfe chemischer Stoffe oder Hormone oder durch den Austausch
von DNA.
Wenn eine extreme Verschlechterung der Lebensbedingungen auftaucht,
kann dies zu einer Mutation führen. Es ist auch möglich, dass
diese Mutanten mehr Kommunikationsmöglichkeiten besitzen. Dies hängt
von der Art der Mutation ab.
Dass die Nährstoffknappheit durch eine Zerklüftung der Kolonieränder
zu überbrücken ist, hat jedes Bakterium in der DNA verankert.
Diese dendritischen Verzweigungen haben wir auch bei einer Zinksulfat-Anlagerung
angetroffen.


Bild N° 6 und 7: Bakterienkolonie und Zinksulfatblätter
Doch wie kann man das Wachstum der Bakterien steuern?
Dazu gibt es eine Fülle von Möglichkeiten. Man kann beispielsweise
die Struktur des Nährbodens verändern, dessen Nährstoffgehalt
herauf oder herab setzten, die Kommunikation der Bakterien verändern
oder schlicht und einfach deren Bewegungsfreiheit steuern. Es ist immer
wieder verblüffend, die Ähnlichkeit zwischen lebendigen und unbelebten
Mustern zu sehen. Es zeigt, dass die Musterbildung ein universeller Bestandteil
der Natur ist.
Ähnliche Strukturen erhalten wir mit dem Programm aus dem Kapitel
"Ablagerungen und Anlagerungen". Diese entsprechen aber nicht dem gleichen Konstruktionsprinzip.
Wichtige Komponenten für eine Simulation sind: Das Muster wird
durch Zellteilung ausgebildet, der Untergrund ist überall gleich beschaffen
und es darf eine Kommunikation zwischen den Zellen stattfinden.
Die Zellteilung kann man simulieren, indem man für den Nährstoffgehalt
des Bodens eine Variable und für den Nährstoffverbrauch einer
Zelle eine Variable angibt. Die Zelle entnimmt dem Boden nun nach je einem
diskreten Zeitschritt eine definierte Menge an Nahrung.
Insofern dass genug Nahrung vorhanden ist, teilt sie sich in eine noch
nicht besetzte aber ansonsten zufällig gewählte Richtung. Ist
der Nährstoffgehalt des Bodens aufgebraucht, findet keine Teilung
mehr statt. Hier könnte man eine Mutation einbauen, bei welcher die
Zelle ein anderes Nahrungsmittel braucht, aber in unserem Beispiel soll
es ohne diese Rettungsfunktion stattfinden. Es ergeben sich Bilder von
Bakterienkulturen. In Bild N° 8 herrscht eine relativ hohe und in Bild
N° 9 eine sehr geringe Nährstoffkonzentration.Beide Kolonien sind
in gleich vielen Zeitschritten gewachsen.

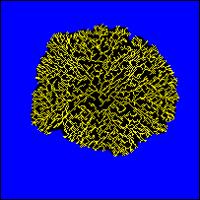
Bild N° 8 und 9: Computerschemata des Wachstums von Bakterien
Nun kann man die Bakterien in ihre digitale Arena lassen und den Kampf
ums Muster angehen.
Wir haben ein Modell geschaffen, in dem keine Kommunikation stattfindet.
Da sich die Bakterien untereinander verständigen, könnte man
ein solches Modul auch noch einbauen. Hierfür lässt man Zellen
in einem vordefinierten Bewegungsrahmen umherschwirren. Sie treffen nun
mit einer definierten Wahrscheinlichkeit auf die Kolonie, die sich nach
einer gewissen Anzahl Treffern mit dem Wanderer verbindet und so das Muster
ausbildet. Die Zellen lagern sich also nicht mehr direkt an, sondern erst
durch diesen Zählprozess. Diesen Zählprozess können wir
als Gedächtnis ansehen. Die Kommunikation ist die Kollision der Wanderer
mit der Kolonie. Es findet eine Zell-Zell Kommunikation statt.
Die so entstehenden Bildern entsprächen dem Wachstum von Bacillus
sublis.
Das Gebiet der Musterbildung im Rahmen der niederen Lebensformen ist
schier unüberschaubar. Die Beispiele sind als Schema gedacht, da die
Wachstumsprozesse meist ähnlich ablaufen. Wir hoffen durch diese zwei
Beispiele einen Anreiz zum selber Forschen gegeben zu haben.